Targeted delivery of chlorogenic acid by mannosylated liposomes to effectively promote the polarization of TAMs for the treatment of glioblastoma
这篇文章研究了通过甘露糖修饰的脂质体靶向递送绿原酸(CHA),以有效促进肿瘤相关巨噬细胞(TAMs)的极化,从而治疗胶质母细胞瘤(GBM)。
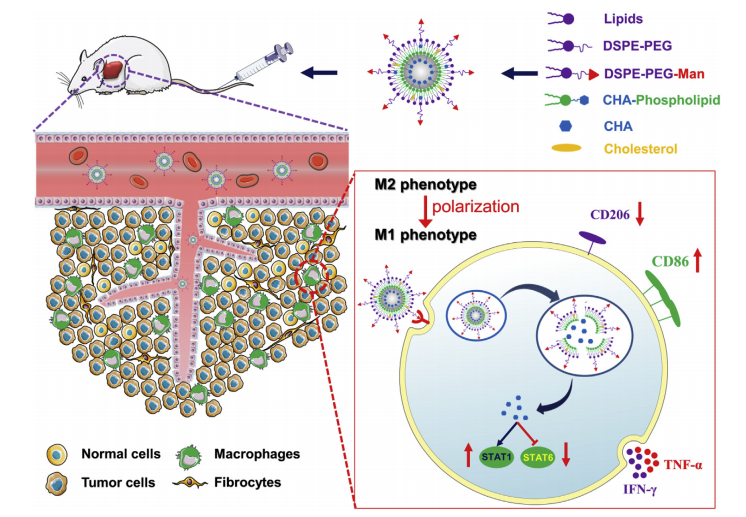 CHA封装的Man-PEG-Lipo示意图,该脂质体通过主动靶向表达甘露糖受体的TAMs增强肿瘤积聚,并促进TAMs的极化用于癌症免疫治疗
CHA封装的Man-PEG-Lipo示意图,该脂质体通过主动靶向表达甘露糖受体的TAMs增强肿瘤积聚,并促进TAMs的极化用于癌症免疫治疗
研究背景
1、胶质母细胞瘤(GBM)是最具侵袭性和常见的恶性原发性脑肿瘤,尽管经过积极治疗,预后仍然不佳。
2、肿瘤微环境在促进GBM的生长和进展中起关键作用,TAMs作为肿瘤微环境中的主要免疫细胞群体,能够促进肿瘤生长、血管生成、进展、转移和免疫抑制。
3、现有研究表明,TAMs通常表现出免疫抑制的M2表型,促进肿瘤进展和转移,因此将TAMs作为癌症免疫治疗的靶点具有潜在价值。绿原酸(CHA)是一种强效的免疫调节剂,能够促进TAMs从M2表型向M1表型极化,但其在临床应用中存在体内快速清除和肿瘤积累低的问题。
研究方法
1、制备了甘露糖修饰的脂质体(Man-PEG-Lipo)用于靶向递送CHA。
2、通过溶剂蒸发法制备了CHA-磷脂复合物,并使用薄膜水合法制备了脂质体。
3、采用动态光散射(DLS)方法测量脂质体的平均粒径和粒径分布,使用透射电子显微镜(TEM)观察脂质体的形态。
4、通过Turbiscan稳定性指数评估脂质体在PBS和含10% FBS的培养基中的物理稳定性。
使用CCK-8试剂盒评估脂质体在RAW264.7巨噬细胞和M2型BMDMs中的体外细胞毒性。
5、通过流式细胞术评估不同脂质体的体外细胞摄取情况,并使用免疫荧光和定量实时PCR分析M2型巨噬细胞的极化能力。
实验设计
1、在体外实验中,评估了Man-PEG-Lipo对M2型巨噬细胞的极化能力和细胞毒性。结果表明,Man-PEG-Lipo显著抑制了M2型巨噬细胞的极化,并且对细胞无明显毒性。
2、在体内实验中,建立了G422胶质瘤小鼠模型,评估了Man-PEG-Lipo的抗肿瘤效果和安全性。通过体内成像和体外荧光成像评估了脂质体的组织分布,结果显示Man-PEG-Lipo在肿瘤部位的荧光强度显著高于其他组。
3、进一步分析了Man-PEG-Lipo在体内的极化能力,通过流式细胞术和免疫荧光分析肿瘤和脾脏组织中M1/M2亚型巨噬细胞的比例,结果显示Man-PEG-Lipo显著增加了M1型巨噬细胞的比例,减少了M2型巨噬细胞的比例。
结果与分析
1、Man-PEG-Lipo在体内外均表现出良好的稳定性和靶向能力,能够有效地将CHA递送到TAMs。
2、Man-PEG-Lipo显著促进了TAMs从M2型向M1型的极化,抑制了G422胶质瘤的生长。
3、在体内实验中,Man-PEG-Lipo组的肿瘤生长抑制率(TGI%)显著高于游离CHA和其他脂质体组,最高可达60.3%。
总体结论
1、研究表明,CHA-封装的甘露糖修饰脂质体能够有效靶向TAMs,促进其从M2型向M1型极化,从而抑制胶质母细胞瘤的生长。
2、这种方法具有潜在的系统毒性低的优点,为GBM的TAMs靶向癌症免疫治疗提供了一种新的策略。
这篇文章展示了甘露糖修饰脂质体在提高CHA的免疫治疗效果方面的潜力,具有重要的临床应用前景。


