STTT丨中山大学徐瑞华/鞠怀强合作研究揭示核线粒体乙酰辅酶A乙酰转移酶1(ACAT1)在NK细胞依赖的抗肿瘤免疫中的作用
肿瘤代谢通常会干扰免疫微环境。尽管自然杀伤(NK)细胞在抗肿瘤免疫中起关键作用,但NK细胞与肿瘤代谢之间的联系仍不清楚。
2025年4月28日,中山大学肿瘤防治中心徐瑞华、鞠怀强共同通讯在Signal Transduction and Targeted Therapy 上发表题为“Nuclear mitochondrial acetyl-CoA acetyltransferase 1 orchestrates natural killer cell-dependent antitumor immunity in colorectal cancer”的研究论文。研究对结直肠癌(CRC)患者的多组学数据和生存数据进行了系统分析,发现了线粒体乙酰辅酶A乙酰转移酶1 (ACAT1)和影响疾病进展的NK细胞浸润之间的新关联。
ACAT1是一种代谢酶,参与乙酰乙酰辅酶A向两个乙酰辅酶A分子的可逆转化,通过其易位表现出核蛋白乙酰化活性。在免疫刺激下,线粒体ACAT1可在丝氨酸60(S60)位点被磷酸化并进入细胞核;然而,在营养贫乏的肿瘤微环境中,这个过程受到阻碍。核ACAT1直接乙酰化p50的赖氨酸146(NFKB1),减弱其DNA结合和转录抑制活性,从而增加免疫相关因子的表达,进而促进NK细胞募集和激活以抑制结直肠癌的生长。此外在CRC中,低核ACAT1水平、降低S60磷酸化和减少NK细胞浸润以及不良预后之间存在显著关联。研究发现揭示了ACAT1作为一个核乙酰转移酶的意想不到的功能,并阐明了它通过p50乙酰化在NK细胞依赖的抗肿瘤免疫中的作用。

结直肠癌(CRC)一直是全球第三大最常见的癌症,被认为是一种免疫原性差的肿瘤。85%的CRC患者表现出微卫星稳定(MSS)表型,表现为新抗原表达受限、CD8+T细胞识别受损和免疫细胞浸润少,从而导致对免疫治疗反应不佳。因此,迫切需要如何改善CRC免疫微环境。
自然杀伤(NK)细胞因其出色的识别和杀伤能力而被称为“专业杀手”,因此在先天免疫系统中始终发挥着至关重要的作用。许多研究表明,肿瘤浸润NK细胞对CRC预后有积极影响。与T和B淋巴细胞相比,NK细胞的识别和激活取决于种系编码的激活和抑制受体产生的整合信号。在激活性受体方面,属于杀伤细胞免疫球蛋白样受体(KIR)家族的KIR2DS可识别HLAⅰ类组织相容性抗原Cα链(HLA-C),并导致NK细胞活化。此外,在大多数NK细胞上表达的凝集素样2型跨膜受体NKG2D识别ul16结合蛋白(ULBP1/ULBP2)和MHCⅰ类链相关蛋白(MICA/MICB),从而促进NK细胞活化和细胞毒性。其他受体包括天然细胞毒性受体(NCRs) NKp30 (NCR3/CD337)、NKp44(NCR2/CD336)和NKp46(NCR1/CD335)。此外,越来越多的研究证实,NK细胞在抗肿瘤免疫中发挥着突出作用,并参与了许多与肿瘤控制相关的过程。然而,NK细胞具有可塑性和异质性,因为它们暴露于复杂的肿瘤微环境(TME)时可表现出不同的表型。TME中的NK细胞功能障碍仍然是针对实体瘤的癌症免疫疗法的主要障碍。
癌症代谢已被广泛接受以影响抗肿瘤免疫。TME中免疫细胞的功能会受到与肿瘤细胞中异常调节的代谢酶相关的多种因素的影响。然而,关于肿瘤代谢对NK细胞的影响知之甚少。因此,探索肿瘤代谢影响NK细胞的机制可能为开发克服CRC的方法提供新的见解。
线粒体乙酰辅酶A乙酰转移酶(ACAT1),位于线粒体基质中的第一种纯化的巯基酶。在合成和降解途径中发挥作用,催化两个乙酰辅酶A分子的Claisen缩合成乙酰乙酰辅酶A或乙酰乙酰辅酶A的逆反应成两个乙酰辅酶A分子,从而参与异亮氨酸降解、生酮、酮解和脂肪酸氧化。因此,ACAT1缺陷通常会导致常染色体隐性遗传性代谢紊乱。ACAT1虽然可能作为线粒体乙酰转移酶发挥作用,但主要靶向特定的线粒体底物。然而,目前对其在线粒体外室中的作用及其作为乙酰转移酶的作用的更广泛影响的理解是有限的。ACAT1促进抗肿瘤免疫的确切机制仍有待完全阐明。
在这项研究中强调了核ACAT1在NK细胞浸润和活化中的作用。研究证明,从机制上讲,位于线粒体中的代谢酶ACAT1可以响应复杂的信号并转位到细胞核。核ACAT1作为乙酰转移酶发挥作用,直接在赖氨酸146(K146)位点乙酰化p50,损害p50的DNA结合和转录抑制活性。因此,可以募集和激活NK细胞的免疫相关因子的表达受到启发,以防止CRC 生长。
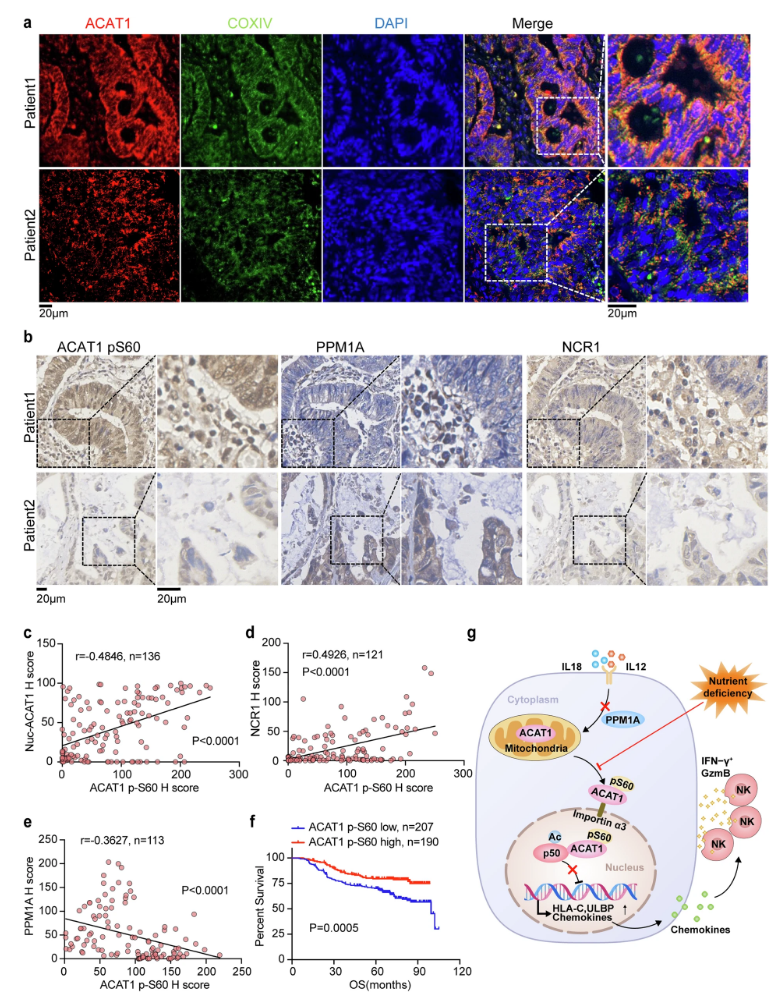
图1 ACAT1 pS60水平在CRC中的临床相关性(摘自Signal Transduction and Targeted Therapy)
参考文献:
Wei C, et al. Nuclear mitochondrial acetyl-CoA acetyltransferase 1 orchestrates natural killer cell-dependent antitumor immunity in colorectal cancer. Signal Transduct Target Ther. 2025 Apr 28;10(1):138.
来源于【iNature】
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!


