线粒体代谢与癌症治疗创新

线粒体是动态细胞器,对细胞能量生成、代谢调控和信号传导至关重要。其复杂的结构使其能够适应多种生理需求。在癌症中,线粒体协调着肿瘤发展的多个关键细胞过程。癌细胞通过代谢重编程,利用有氧糖酵解、谷氨酰胺代谢和脂质代谢改变,支撑其不受控制的增殖、存活和治疗抵抗。线粒体及核DNA的遗传和表观遗传改变会破坏氧化磷酸化、三羧酸循环动态及氧化还原稳态,从而驱动肿瘤进展。肿瘤中的线粒体功能障碍具有高度异质性,影响着不同癌种的疾病表型和治疗反应。在肿瘤微环境中,线粒体通过调节T细胞存活与功能、巨噬细胞极化、自然杀伤(NK)细胞毒性以及中性粒细胞活化,深刻影响着免疫应答。它们还介导基质细胞的功能,尤其是在癌症相关成纤维细胞和肿瘤内皮细胞中。尽管靶向线粒体功能是一种有前景的治疗策略,但线粒体异质性和适应性抵抗机制使得干预方法复杂化。线粒体基因组编辑技术、蛋白质组学以及循环线粒体DNA分析等领域的进展,提升了肿瘤诊断的精确性。本综述整合了线粒体在癌症研究领域的发展态势,全面概述了线粒体的结构动态、代谢可塑性、信号网络及其与肿瘤微环境的相互作用。最后,我们探讨了开发有效基于线粒体的癌症干预措施所面临的转化挑战。
线粒体功能、调控及细胞死亡通路的综合概述
线粒体常被称为“细胞动力站”,是通过氧化磷酸化(OXPHOS)产生ATP的主要场所。除产能外,线粒体还调控着包括信号通路、钙稳态和细胞凋亡在内的关键细胞过程。其复杂的结构支持着多样化的功能,使其对细胞的存活、生长和适应不可或缺。在癌细胞中,线粒体结构和功能的改变是肿瘤发生发展的关键特征,深刻影响着细胞的代谢重编程和生存适应性。
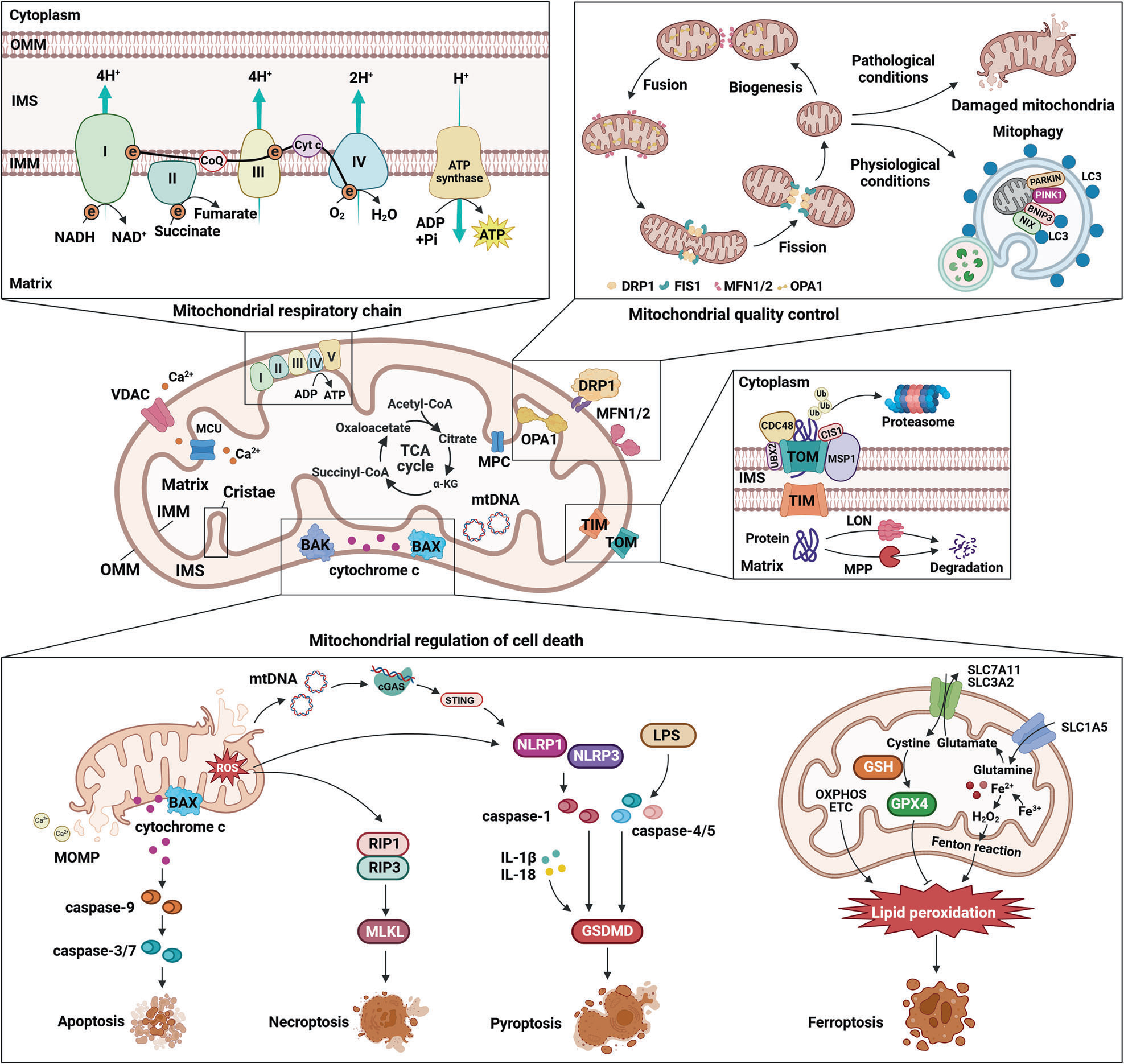
线粒体是具有复杂结构的细胞器,其精密的构造包含外膜、内膜、嵴(内膜折叠形成的结构)以及众多关键蛋白质,这些结构共同促进了能量产生和细胞调控。线粒体呼吸链通过电子传递和质子泵送驱动 ATP 合成;与此同时,融合、分裂和线粒体自噬等质量控制机制则维持着细胞的健康状态。线粒体过程调控着包括凋亡、坏死性凋亡、焦亡和铁死亡在内的多种细胞死亡途径。这些过程涉及关键的蛋白质和信号分子,它们介导细胞对压力和损伤的响应,最终确保细胞存活与清除的精确控制。
线粒体代谢与应激适应在癌症中的作用
恶性转化以显著的代谢重编程为特征,癌细胞在其生物能代谢和生物合成通路中展现出惊人的可塑性,以维持快速增殖和生存。这种代谢重编程的核心在于线粒体功能的广泛改变,这使得癌细胞与正常细胞在根本上区别开来。这种重编程涵盖了代谢酶性质、上游调节机制以及下游代谢物谱的全面改变。
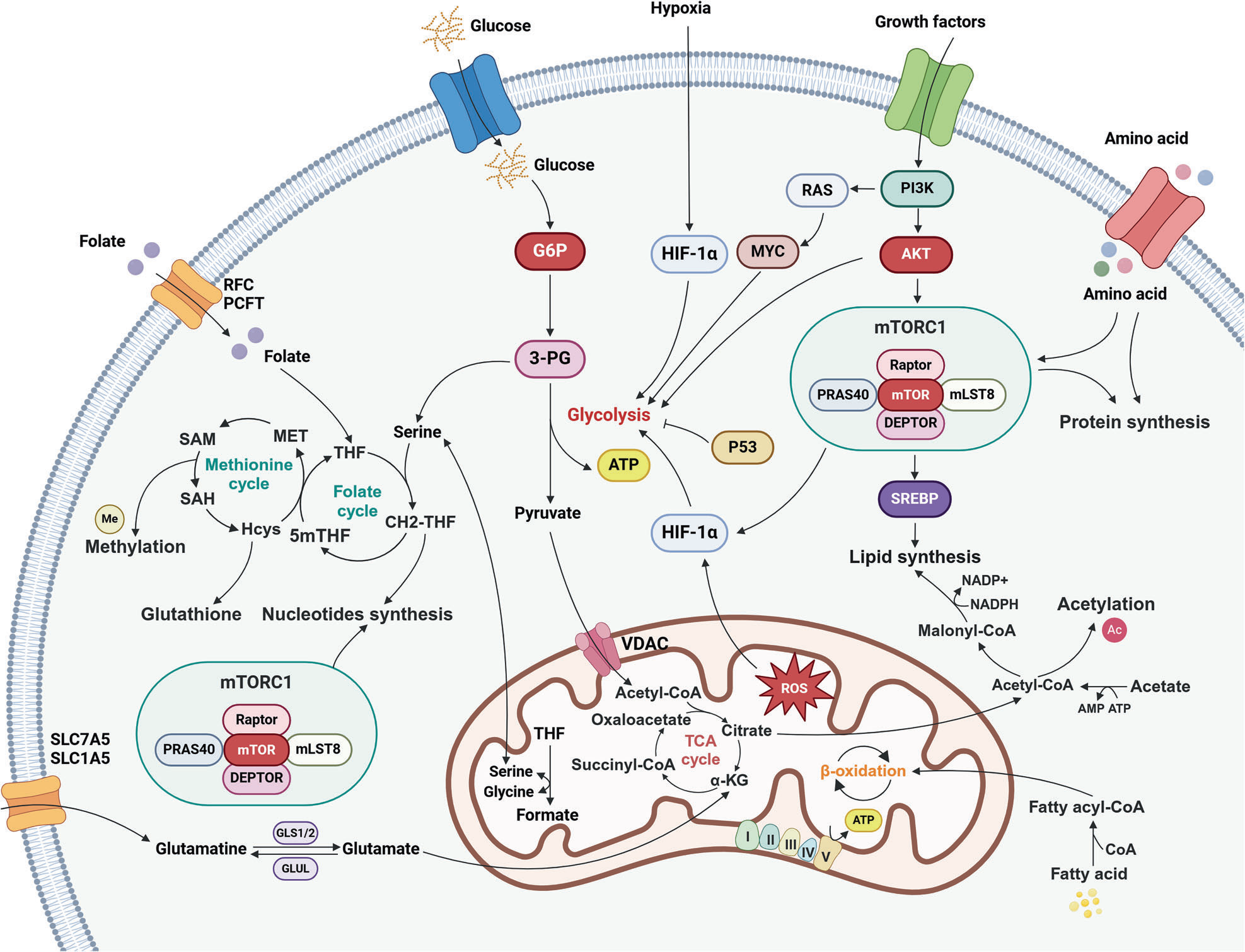
癌细胞发展出精密的代谢策略,以在恶劣条件下维持其持续增殖。这些适应性改变包括:增强葡萄糖摄取(即瓦伯格效应 / Warburg effect)、提升谷氨酰胺代谢以补充能量循环、激活一碳代谢支持生物合成、以及进行线粒体重编程以促进脂质生成和维持氧化还原平衡。通过动态调节这些代谢途径,癌细胞能够生成必需的代谢中间体,维持高效的生物能量供应,从而在通常抑制细胞生长和功能的营养匮乏或低氧环境中存活下来。
调控癌细胞线粒体功能与适应性的信号网络
线粒体信号网络通过关键代谢传感器(如AMPK、mTOR和Sirtuins)将代谢状态与癌症进展相整合,在恶性转化过程中协调细胞能量代谢。
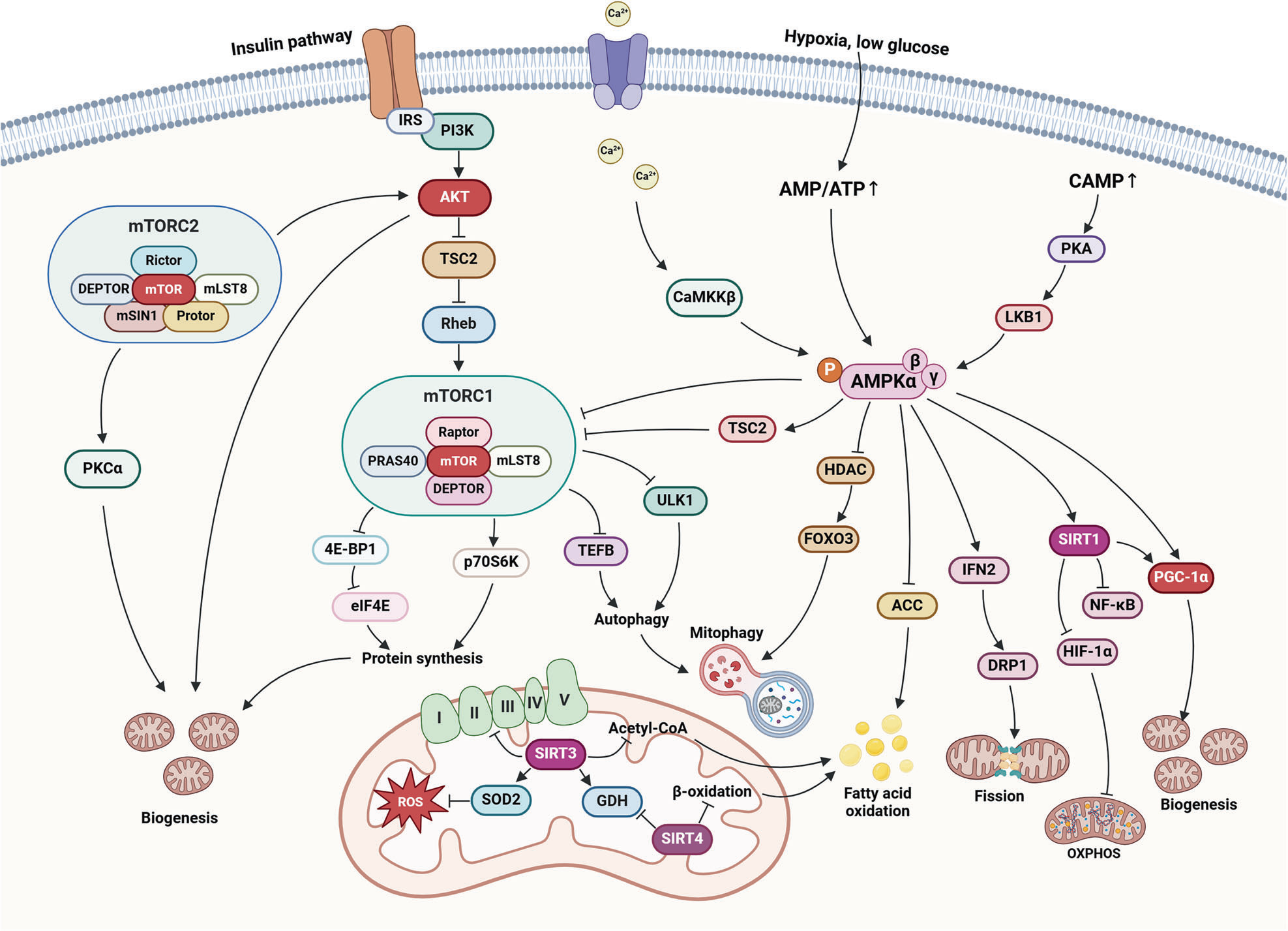
癌细胞的存活依赖于复杂且动态调控线粒体功能的信号网络。胰岛素通路通过激活 PI3K 和 AKT 刺激 mTORC1 来驱动细胞生长;而 AMPK 则在应激条件下充当关键的代谢传感器。当 AMPK 激活时,它通过与 ULK1、SIRT1 和 PGC-1α 等关键蛋白相互作用,调控线粒体动力学、自噬及能量代谢。此外,SIRT3 等线粒体蛋白通过管理氧化应激和维持代谢平衡,进一步促进细胞适应性。这些相互关联的信号通路使癌细胞能够在恶劣环境中存活并适应,也提示了潜在的治疗干预靶点。
线粒体对肿瘤微环境中细胞相互作用的调控
线粒体在肿瘤细胞与肿瘤微环境(TME)中浸润的各种免疫细胞群之间的动态相互作用中发挥核心作用。尽管肿瘤细胞常通过重塑自身线粒体以增强增殖和生存能力,但这些变化对免疫细胞线粒体产生多方面影响,既塑造抗肿瘤反应,也诱导免疫抑制反应。
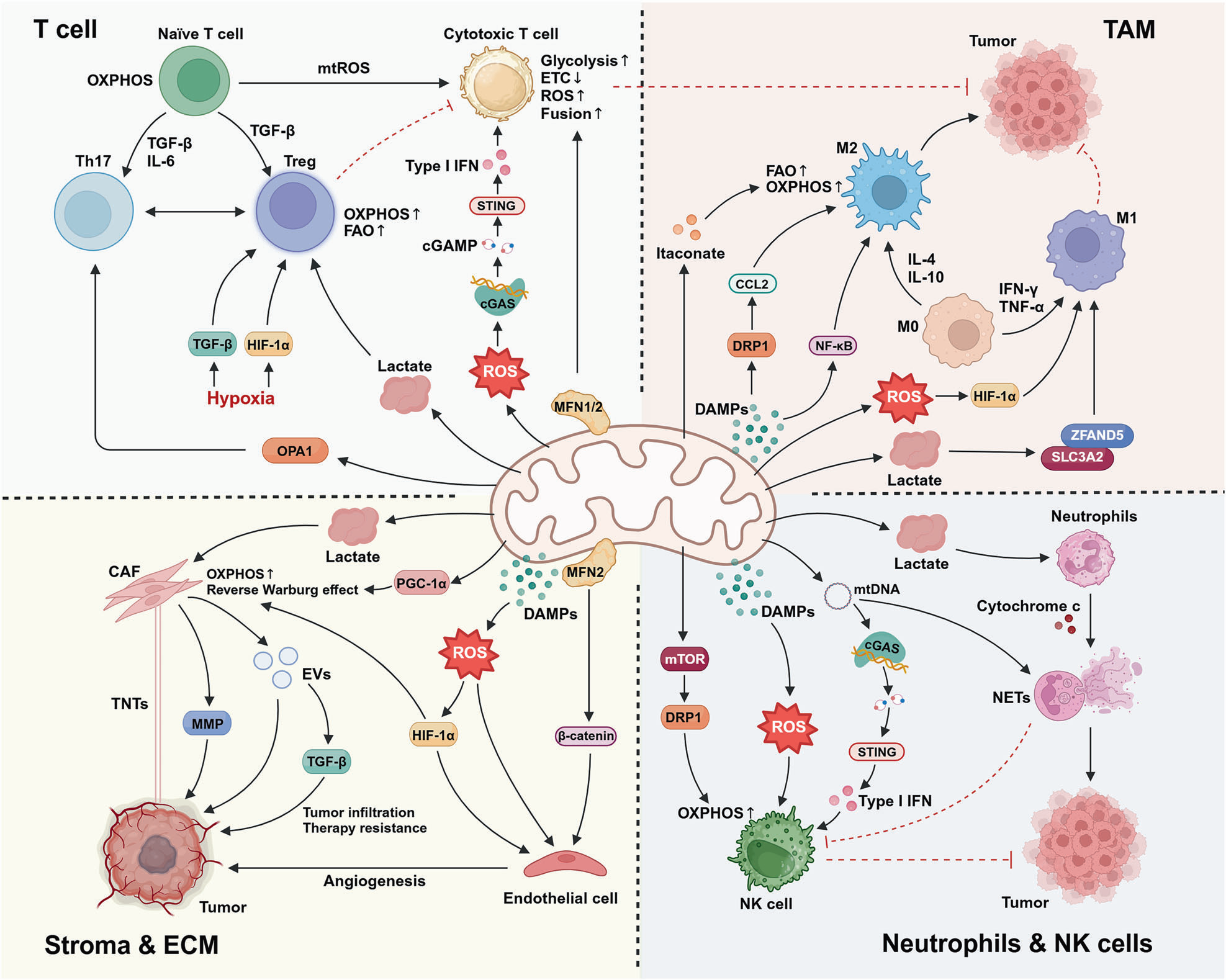
线粒体在协调肿瘤微环境内的代谢与免疫应答中发挥着关键作用。不同的免疫细胞类型展现出独特的代谢适应性:T细胞在氧化磷酸化和糖酵解之间切换;巨噬细胞通过代谢重编程在促癌与抗癌状态之间极化;自然杀伤(NK)细胞则依赖特定的代谢途径维持其抗肿瘤活性。与此同时,癌症相关成纤维细胞通过提供能量物质和信号分子来支持肿瘤代谢。这些由线粒体介导的复杂相互作用既调控着肿瘤进展和免疫应答,也可能影响潜在的治疗抵抗,从而凸显了肿瘤微环境中错综复杂的代谢格局。
线粒体介导的肿瘤微环境中的细胞间信号传递
免疫细胞通过代谢活动、细胞因子产生和直接细胞毒性作用来对抗这些适应性变化,这可能对肿瘤线粒体施加代谢压力。值得注意的是,这些线粒体相互作用的精确机制及其整体影响在不同肿瘤类型中存在差异,这反映了各种代谢依赖性、微环境因素和内在生物学特征。
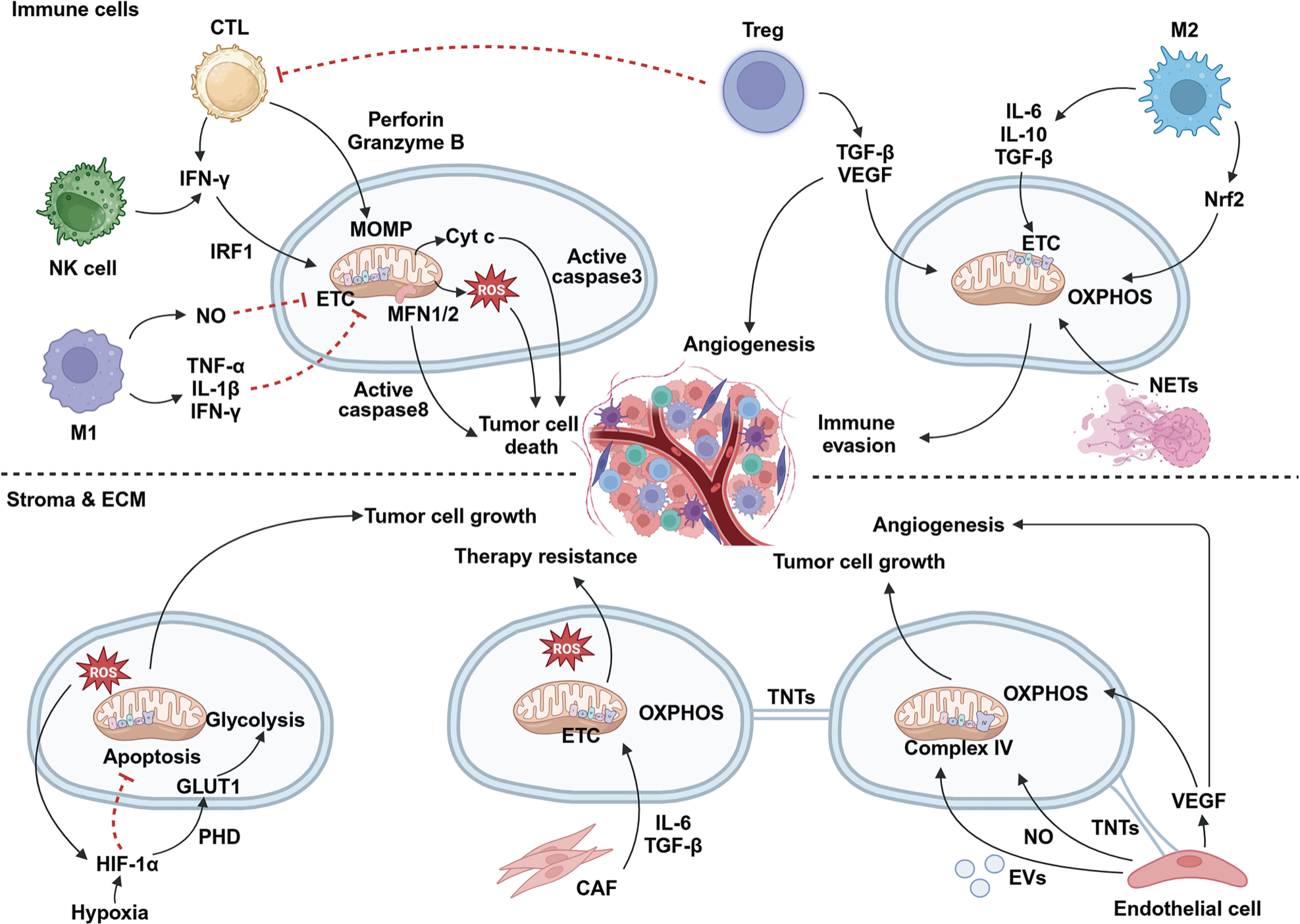
线粒体介导的相互作用驱动着肿瘤微环境内复杂的细胞动态。免疫细胞,如细胞毒性T淋巴细胞(CTL)、自然杀伤(NK)细胞和M1型巨噬细胞,通过产生活性氧(ROS)和释放炎症信号来发挥抗肿瘤效应。而免疫抑制细胞,如调节性T细胞(Treg)和M2型巨噬细胞,则通过分泌生长因子促进肿瘤存活。癌症相关成纤维细胞(CAF)则通过提供代谢底物和信号分子支持肿瘤进展。与此同时,肿瘤细胞通过改变线粒体功能、增强代谢可塑性以及构建复杂的细胞间通讯网络进行适应,这些网络最终促进肿瘤存活、血管生成并产生对治疗干预的抵抗。
代表性线粒体治疗靶点及其调节剂
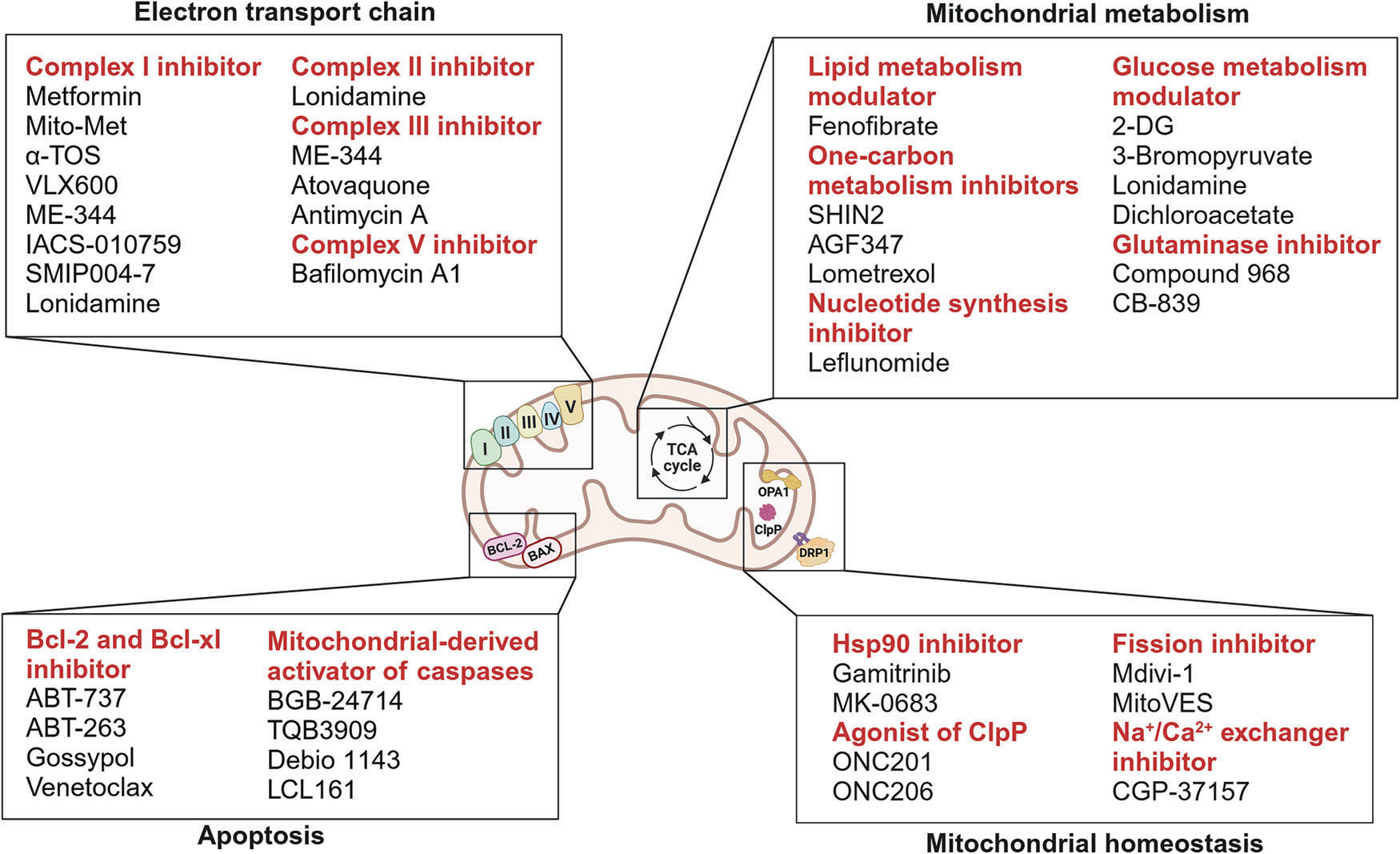
该示意图展示了线粒体靶向治疗的四大主要干预领域:首先是靶向复合体 I-IV 的电子传递链抑制剂;其次是调节线粒体代谢的化合物,其作用机制涵盖调控脂质代谢、葡萄糖代谢、一碳代谢及谷氨酰胺代谢;第三类为凋亡通路调节剂,包括靶向抗凋亡蛋白 Bcl-2/Bcl-xl 的抑制剂以及线粒体源性胱天蛋白酶(caspase)激活剂;最后则是线粒体稳态调节剂,这类干预手段包含热休克蛋白90(Hsp90)抑制剂、酪蛋白溶解蛋白酶(ClpP)激动剂、线粒体分裂调节剂以及钠钙交换(Na+/Ca2+ exchanger)调节剂。
结论
线粒体是调控癌症发生、发展及治疗耐药性的复杂生物过程的核心。其在代谢重编程、应激反应、信号传导及细胞间通信中的多维作用,使其成为肿瘤生物学中的关键调控因子及主要干预靶点。对线粒体功能的深入理解不仅揭示了这些细胞器复杂的内在机制,还凸显了其作为创新癌症治疗关键介导者的潜力。尽管已取得重大突破,但将线粒体靶向策略转化为临床成功仍面临挑战。不同肿瘤类型中线粒体行为的显著异质性强调了精准治疗策略的必要性。此外,肿瘤细胞与肿瘤微环境(TME)之间的动态相互作用,包括间质成分、免疫细胞及缺氧条件,进一步增加了治疗靶向的复杂性。线粒体靶向药物的不良反应要求开发精确的给药机制,并识别肿瘤特异性线粒体脆弱性。
未来研究应优先深入理解肿瘤特异性线粒体特征及脆弱性。揭示不同肿瘤类型中线粒体动态、生物能学及信号传导通路的差异,将为开发有效的个性化预测工具和治疗策略提供关键洞见。此外,优化给药机制以实现精准线粒体靶向,并将这些疗法整合到联合治疗方案中,可提升疗效并减少不良反应。关键的是临床前和临床研究还需探讨线粒体靶向策略中固有的潜在适应性耐药机制。
癌症线粒体研究领域正处于一个令人振奋的转折点,为肿瘤学变革带来了前所未有的机遇。通过利用线粒体的独特特性,研究人员和临床医生能够应对癌症治疗中长期存在的挑战,包括治疗耐药性和免疫逃逸。对线粒体代谢及其治疗效果的持续探索,有望开启精准肿瘤学的新时代。这一范式转变有望显著改善患者预后,并推动全球抗癌努力。
参考文献:
Du H, Xu T, Yu S, Wu S, Zhang J. Mitochondrial metabolism and cancer therapeutic innovation. Signal Transduct Target Ther. 2025 Aug 4;10(1):245.
https://www.nature.com/articles/s41392-025-02311-x
来源于【研壹生物】
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!


