处于十字路口的胶质母细胞瘤:当前的认识和未来的治疗前景

胶质母细胞瘤(GBM)仍然是侵袭性最强、致死率最高的成人脑肿瘤,给患者的生存带来了巨大挑战。本综述全面探讨了 GBM 的分子和遗传结构,重点关注表皮生长因子受体 (EGFR)、血小板衍生生长因子受体 (PDGFR) 和 PI3K/ AKT/mTOR 通路等对肿瘤发生和发展至关重要的关键致癌因素。我们深入研究了表观遗传学改变(包括 DNA 甲基化和组蛋白修饰)在驱动耐药性和肿瘤演变中的作用。众所周知,肿瘤微环境在免疫逃避中起着关键作用,与肿瘤相关的巨噬细胞、髓源抑制细胞和调节性 T 细胞形成了一个免疫抑制龛,维持着 GBM 的生长。免疫疗法、溶瘤病毒疗法、基于细胞外囊泡的方法和非编码 RNA 干预等新兴疗法被强调为破坏 GBM 发病机制的有前途的途径。本综述还讨论了精准医疗和创新技术的进展,包括电场疗法和局部治疗,因为它们具有克服血脑屏障和治疗耐药性的潜力。此外,本综述还强调了新陈代谢重编程的重要性,尤其是缺氧驱动的适应性和脂质代谢的改变,它们助长了 GBM 的发展并影响了治疗反应。胶质瘤干细胞在肿瘤复发和耐药性中的作用也得到了强调,突出了靶向治疗方法的必要性。通过整合分子靶向、免疫能量学和技术进步,本综述概述了改善 GBM 治疗效果的多学科框架。最终,基因、代谢和免疫策略的融合为 GBM 的治疗提供了变革性的潜力,为提高患者生存率和生活质量铺平了道路。
胶质母细胞瘤的前景和靶向治疗之路
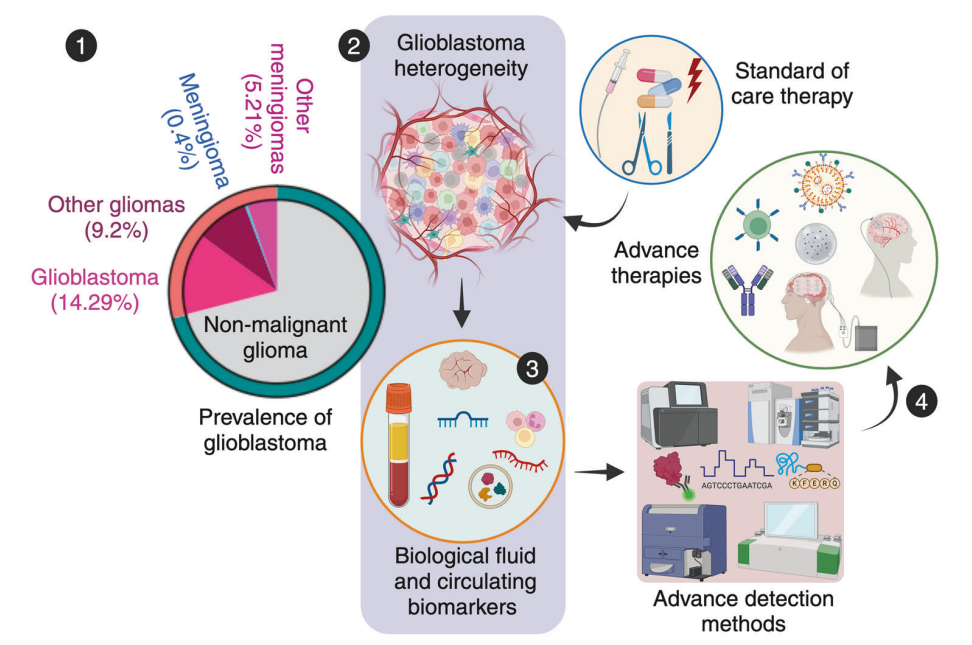
图1 胶质母细胞瘤的前景和靶向治疗路径
图1中,1.显示了胶质瘤的发展趋势,重点是美国胶质母细胞瘤(GBM)的发病率。数据来源: Cancer Stat Facts:2014-2020 年美国国家癌症研究所监测、流行病学和最终结果计划确定的脑癌和其他神经系统癌症。2. GBM 具有明显的分子、遗传和细胞异质性,给准确诊断和有效治疗带来了巨大障碍。3.利用生物流体生物标志物(如液体活检和循环生物大分子)以及高清检测技术的先进诊断方法对于精确检测至关重要。4.这些创新技术正推动着针对 GBM 治疗的靶向和更有效疗法的发展。
胶质瘤的临床和分子分级
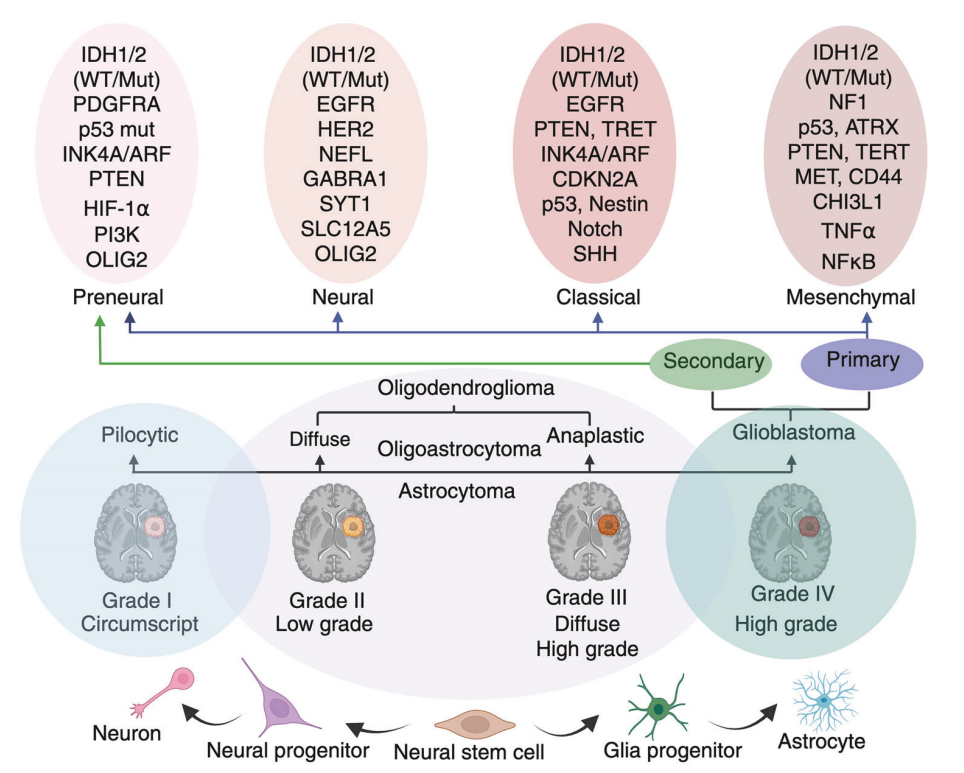
图2 胶质瘤的临床和分子分级
图2胶质瘤的分子分类和组织病理学分级示意图,以及其细胞起源和发展过程。从神经干细胞到神经元、星形胶质细胞和胶质祖细胞的发展脉络。嗜酸性星形细胞瘤(Ⅰ级)通常是局限性和低级别的,而弥漫性星形细胞瘤(Ⅱ级)、无弹力星形细胞瘤(Ⅲ级)和胶质母细胞瘤(Ⅳ级)则代表恶性和浸润行为的进展阶段。顶部面板突出显示了胶质母细胞瘤的分子亚型:绒毛膜亚型、神经亚型、典型亚型和间质亚型,每种亚型都由不同的基因,如 IDH1/2、表皮生长因子受体(EGFR)、p53、PTEN、NF1 和其他基因改变所定义。这些亚型与胶质母细胞瘤的原发(新发)或继发(从低级别胶质瘤发展而来)起源相关。这种分类强调了胶质瘤的诊断、预后和治疗决策需要结合分子和临床参数。
胶质母细胞瘤的表观遗传学特征及其在发病机制中的作用
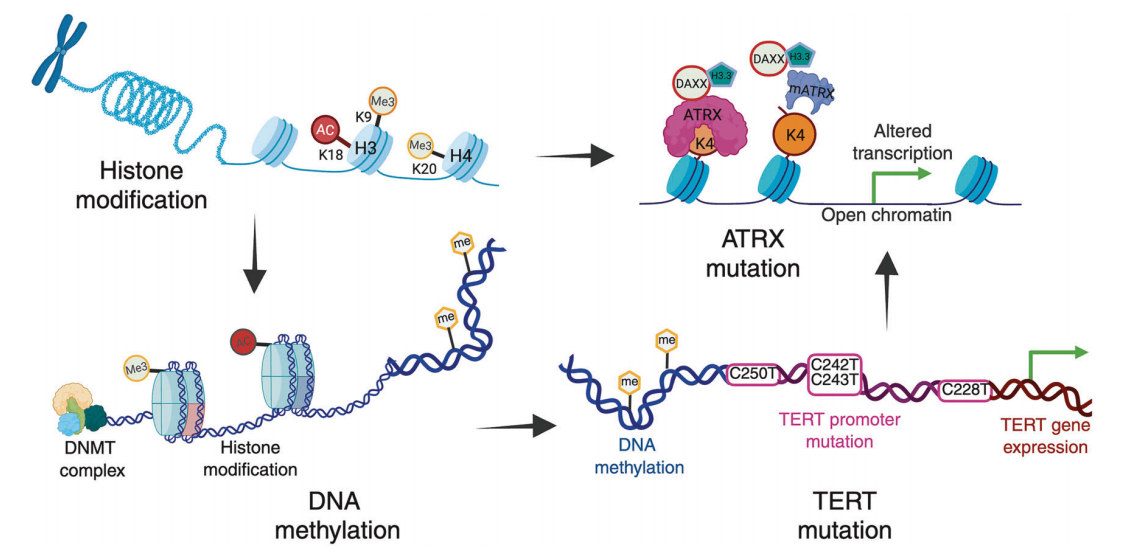
图3 胶质母细胞瘤的表观遗传学特征及其在发病中的作用
图3 描述了导致胶质母细胞瘤(GBM)发展的关键表观遗传学机制,包括组蛋白修饰、DNA 甲基化、ATRX 突变和 TERT 启动子突变。组蛋白修饰(如甲基化(Me3)和特定赖氨酸残基的乙酰化(Ac))可调节染色质的可及性和基因表达。由 DNA 甲基转移酶(DNMTs)催化的 DNA 甲基化进一步影响基因的沉默或激活。ATRX 基因突变会破坏负责 H3.3 沉积的 ATRX-DAXX 复合物,从而损害染色质重塑,导致转录改变和染色质可及性增加。TERT 启动子突变会导致端粒酶表达异常,从而导致肿瘤细胞永生。
驱动胶质母细胞瘤发病机制的基因改变
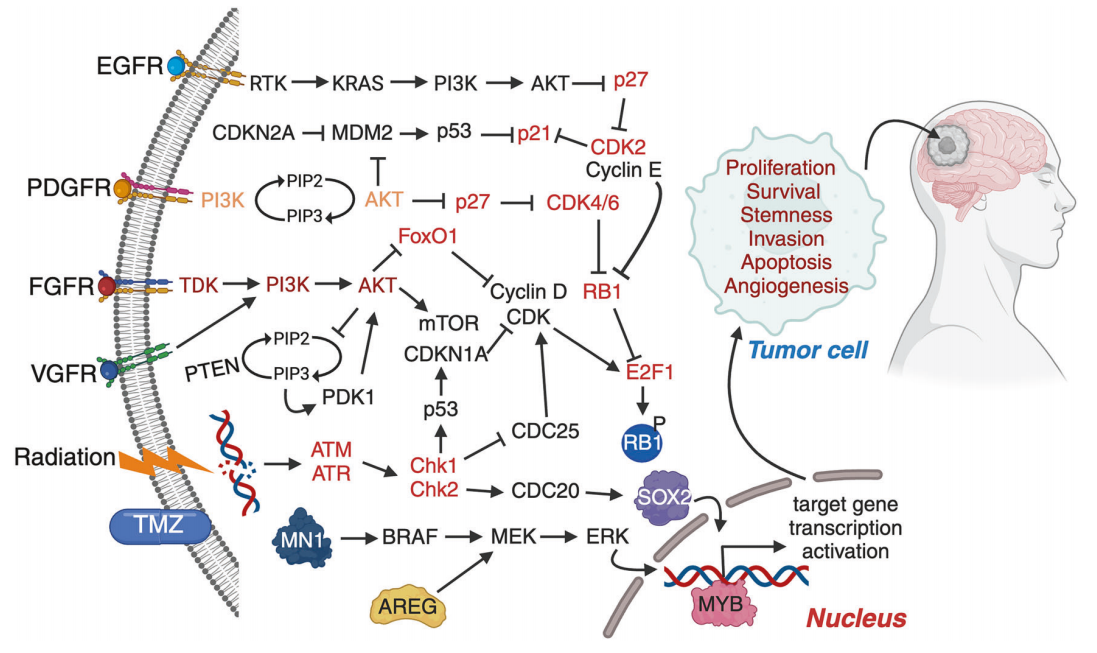
图4 胶质母细胞瘤GBM发生和发展的关键致癌基因
图4说明了导致胶质母细胞瘤(GBM)发生和发展的关键致癌基因改变。受体酪氨酸激酶(RTK),如表皮生长因子受体(EGFR)、表皮生长因子受体(PDGFR)、表皮生长因子受体(FGFR)和表皮生长因子受体(VGFR),启动下游信号级联,包括 PI3K/AKT/mTOR 和 RAS/RAF/MEK/ERK 通路。肿瘤抑制因子(如 PTEN、CDKN2A、RB1、p53)的缺失和癌基因(如表皮生长因子受体、MDM2、CDK4/6、TERT、MYB、SOX2、AREG)的过度激活会促进细胞周期的进展、增殖、干细胞、存活、血管生成和对凋亡的抵抗。DNA 损伤反应元件(ATM/ATR-Chk1/Chk2)会被放疗和化疗(TMZ)激活,但在 GBM 中经常被绕过。MYB和SOX2等下游转录调节因子进一步增强了肿瘤细胞的可塑性和恶性程度。总之,这些改变重塑了肿瘤细胞表型,推动了 GBM进展和耐药性。
胶质母细胞瘤中失调的分子信号通路和串扰
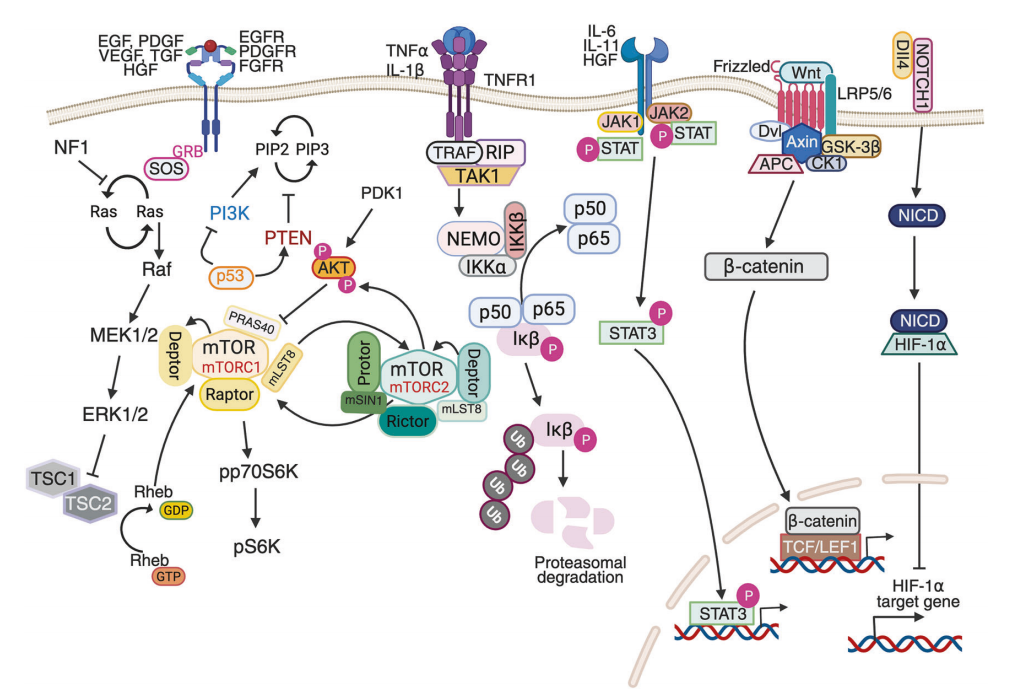
图5 胶质母细胞瘤中失调的分子信号通路及其串扰
图5突出了关键的致癌信号通路及其在胶质母细胞瘤(GBM)发病机制中的相互关联作用。PI3K/AKT/mTOR、MAPK/ERK、p53、NF-κB、JAK/STAT、β-catenin 和 Notch 等失调通路共同推动了肿瘤的进展、生存和抗药性。由 TNFα/TNFR1 和 IKK 复合物引发的 NF-κB 激活整合了炎症信号,而细胞因子介导的 JAK/STAT 通路激活则促进了生存基因的转录。Wnt/β-catenin 和 Notch 通路进一步支持干性、血管生成和免疫调节。这些通路之间的交汇和串扰导致了 GBM 的复杂性和侵袭性。
调节肿瘤相关免疫抑制的关键免疫信号通路
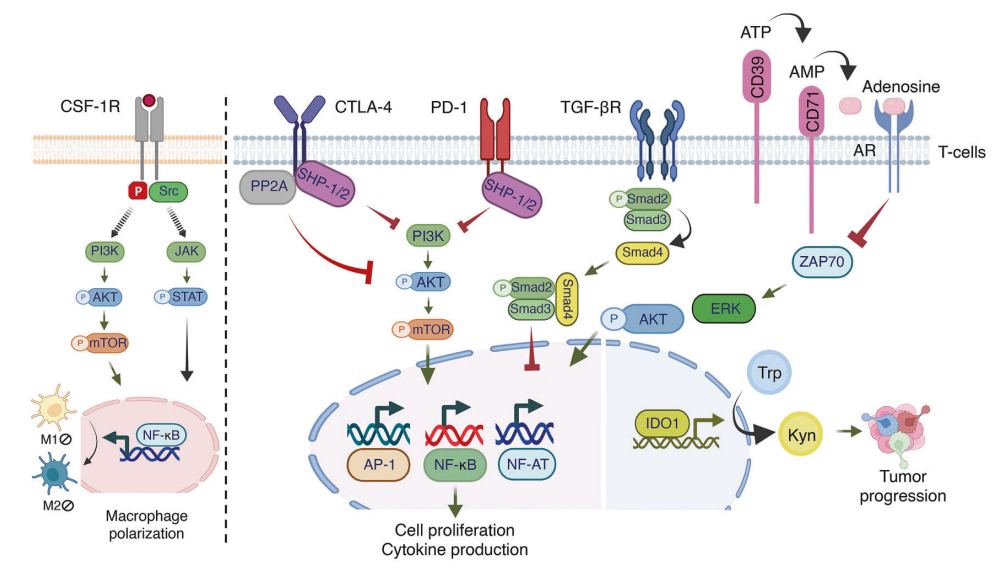
图6 调控肿瘤相关免疫抑制的关键免疫信号通路
在巨噬细胞中,CSF-1 或 IL-34 与 CSF-1 受体结合,诱导快速二聚化和酪氨酸残基的自身磷酸化。这种激活通过 PI3K/AKT 和 JAK/STAT 途径触发下游信号,调节巨噬细胞的极化。活化的 T 细胞上表达的 CTLA-4 与 APC 上的 CD80/CD86 结合。一旦接合,CTLA-4 信号就会使 TCR 信号成分去磷酸化,从而抑制 CD3 和 ZAP70 的活化,并抑制 RAS 信号通路。CTLA-4 信号会破坏 AKT 磷酸化,对细胞周期进行负向调节,并抑制 NF-κB、AP-1 和 NF-AT 等关键转录因子。PD-1 与其配体相互作用,导致其胞质尾部的两个酪氨酸残基磷酸化。这种磷酸化作用会将 SHP-1 和 SHP-2 募集到 ITSM 矩阵,抑制 PI3K/AKT/mTOR 通路,降低代谢活性,促进 T 细胞衰竭。在 TGF-βR2 配体结合的情况下,受体通过与 PI3K 亚基的物理相互作用激活并促进 PI3K 和 AKT 信号传导。这种级联反应导致 mTOR 激酶激活,从而推动翻译反应。这些信号通路共同诱导 IDO1 激活,将色氨酸转化为犬尿氨酸,从而通过免疫抑制增强肿瘤的免疫逃避能力。CD39/CD73 通路将细胞外 ATP 水解为腺苷,这是一种免疫抑制代谢产物。腺苷能阻止幼稚αCD3/CD28刺激的CD8+T细胞中ZAP70、AKT和ERK1/2的酪氨酸磷酸化,从而影响它们的活化。
用于临床管理的现有和新兴胶质母细胞瘤疗法
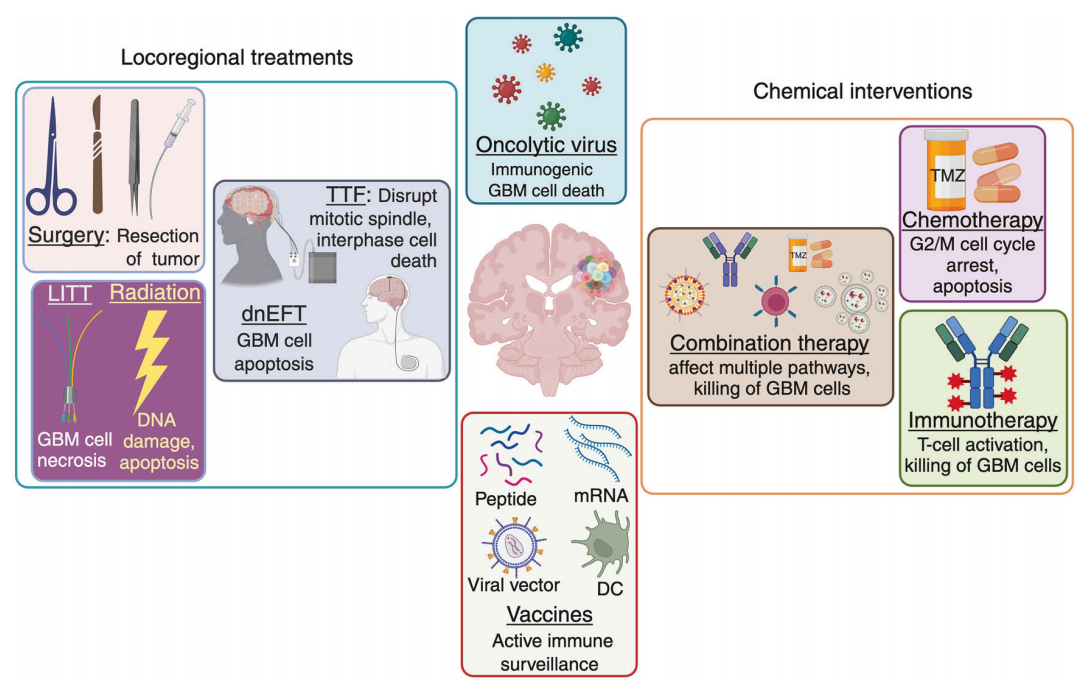
图7当前及新兴胶质母细胞瘤临床管理治疗策略
图7概述了目前用于临床治疗胶质母细胞瘤(GBM)的治疗策略。局部治疗包括手术切除、激光间质热疗(LITT)和放射治疗,旨在通过直接的细胞毒性作用消除肿瘤组织。肿瘤治疗场(TTFs)和定向非旋转电场疗法(dnEFTs)可促进有丝分裂破坏和细胞凋亡。化学干预包括化疗(TMZ)和免疫疗法,前者可诱导 G2/M 停滞和细胞凋亡,后者可增强 T 细胞介导的肿瘤杀伤力。肿瘤溶解病毒可诱导免疫性细胞死亡,而多肽、mRNA、病毒载体等治疗性疫苗以及基于树突状细胞的平台可刺激免疫监视。联合疗法利用多种方式同时针对不同的致癌途径,为克服抗药性和推进个性化 GBM 治疗提供了一条前景广阔的途径。
胶质母细胞瘤治疗面临的主要挑战和未来治疗前景
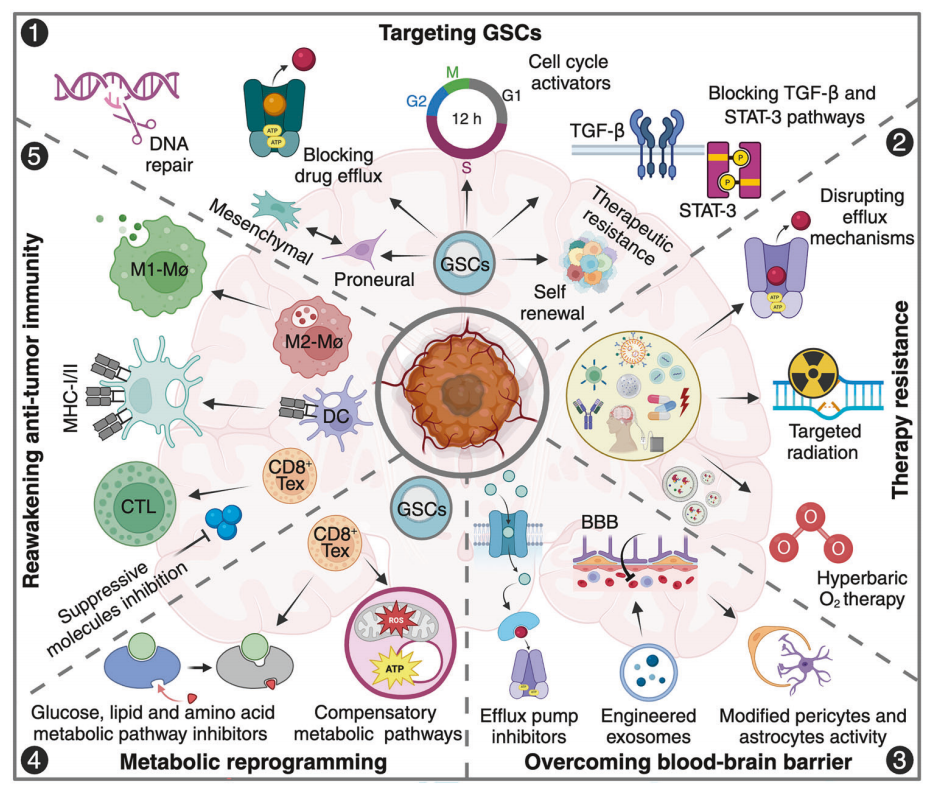
图8 胶质母细胞瘤治疗的主要挑战与未来治疗前景
图8重点介绍了神经胶质瘤干细胞(GSCs)、耐药性、血脑屏障(BBB)、代谢重编程和免疫适应等关键方面。
1. 胶质母细胞瘤(GBM)肿瘤微环境(TME)是导致耐药性和疾病进展的原因之一。胶质母细胞瘤具有自我更新能力和可塑性,导致肿瘤复发和治疗失败。绒毛膜向间质的转化突显了 GBM 的异质性,使治疗策略更加复杂。
2. 耐药机制,包括基因突变、表观遗传修饰和适应性生存途径,是有效治疗的关键障碍。这些机制使 GBM 细胞能够逃避化疗、放疗和靶向治疗。
3. 这项研究凸显了克服 BBB 的挑战,BBB 限制了药物的渗透,并限制了全身疗法的疗效。前景涉及工程EV介导的药物递送、外排泵抑制剂以及改造的周细胞和星形胶质细胞等策略,以增加治疗药物进入肿瘤部位的机会。
4. 代谢重编程涉及 ATP 生成、脂质代谢和糖酵解的改变,它们为肿瘤的快速生长提供能量。通过使用线粒体抑制剂、糖酵解调节剂和脂质代谢干扰物来靶向代谢弱点是一种新兴的治疗方法。
5. 在 GBM 中,肿瘤相关巨噬细胞(TAMs)、调节性 T 细胞(Tregs)和衰竭的 CD8+ T 细胞(Tex)造成了免疫抑制环境。免疫治疗策略,包括检查点抑制剂、基于树突状细胞(DC)的疫苗和巨噬细胞表型重编程(M2 到 M1),旨在恢复抗肿瘤免疫力并改善治疗反应。
该示意图强调了 GBM 病理生理学的多面性,并强调了综合靶向治疗、免疫治疗、代谢干预和 BBB 调节策略的多模式方法对提高疗效和改善患者预后的必要性。
CD8+ T 细胞衰竭过程中的转录和表观遗传调控及功能动态变化
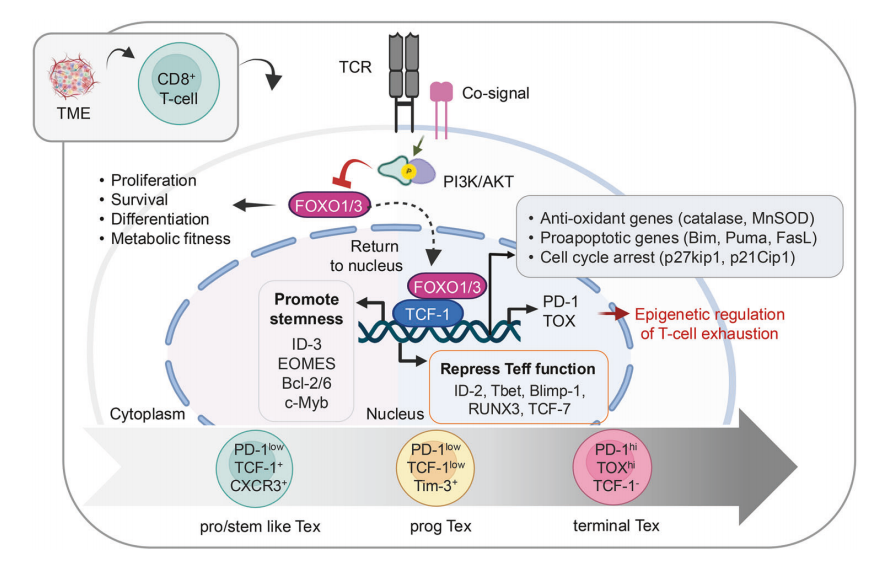
图9 CD8⁺ T 细胞耗竭的转录与表观遗传调控及其功能动态
图9 描述了信号通路和转录调节因子之间错综复杂的相互作用,这种相互作用推动了 TME 中 CD8+ T 细胞的衰竭。关键通路包括PI3K/AKT信号通路和FOXO1/3转录因子的活性调节。在细胞核中,TCF-1通过上调ID-3、EOMES、Bcl-2/6和c-Myb等基因促进干性。FOXO1/3与TCF-1一起,通过调节衰竭相关基因(ID-2、Tbet、Blimp-1、RUNX3和TCF-7),抑制效应T细胞(Teff)的功能。衰竭的 T 细胞会经历一个连续过程,从祖细胞样(pro/stem-like Tex)状态(PD-1-low、TCF-1+ 和 CXCR3+)过渡到最终衰竭(terminal Tex)状态(PD-1hi、TOXhi 和 TCF-1-)。FOXO1/3 还能控制抗氧化基因和促凋亡基因,调节细胞周期停滞基因,维持细胞完整性并上调 PD-1 和 TOX。PD-1 和 TOX 起着表观遗传调控中心媒介的作用,影响染色质的可及性和转录程序,从而稳定衰竭表型。这种 PD-1 表观遗传学调控塑造了肿瘤微环境中的 T 细胞功能和代谢适应性。
尽管在了解 GBM 发病机制方面取得了重大进展,但由于肿瘤的异质性、适应性以及与 TME 的复杂相互作用,有效的治疗方法仍然难以捉摸。未来的研究必须优先考虑同时针对多种致癌通路的新型药物组合疗法,以破坏 GBM 的适应机制并克服耐药性。通过将基因组学、转录组学、代谢组学和表观基因组学见解与生物标志物驱动的治疗选择和人工智能驱动的预测模型相结合,个性化和精准医学提供了前景广阔的策略。这些方法通过识别患者的特异性弱点来优化治疗方案。然而,要充分发挥这些方法的临床潜力,还必须应对生物标志物验证、完善治疗范式和确保先进诊断的可及性等挑战。免疫疗法前景广阔,但也面临着 T 细胞衰竭、检查点抑制剂抗药性和抗原异质性等障碍。未来的研究方向应集中在重编程免疫抑制TME、增强T细胞浸润和功能以及开发下一代免疫疗法。改进的 CAR-T 细胞设计、基于 OV 的疗法和基于 mRNA 的癌症疫苗等创新技术与代谢和表观遗传学修饰相结合,可显著提高免疫反应。此外,克服 BBB 和药物外流等关键障碍对于改善药物输送和减少肿瘤复发至关重要。聚焦超声、纳米材料药物载体和电场疗法等新兴技术为提高治疗渗透和疗效提供了新的解决方案。精准治疗、分子靶向、免疫调节和代谢干预的整合为应对 GBM 提供了一个全面的框架。跨学科合作和创新性临床试验设计对于将这些科学进步转化为变革性临床干预措施至关重要。通过利用这些创新策略,该领域已更接近于显著改善 GBM 患者的生存和生活质量。
参考文献:
Singh S, Dey D, et al. Glioblastoma at the crossroads: current understanding and future therapeutic horizons. Signal Transduct Target Ther. 2025 Jul 9;10(1):213.
https://www.nature.com/articles/s41392-025-02299-4
来源于【研壹生物】
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!


