Cell Death Differ丨血管内皮“刹车”分子有望抑制胶质母细胞瘤恶性进展
胶质母细胞瘤作为成人中枢神经系统最具侵袭性的原发性恶性肿瘤,其治疗仍面临重大挑战。目前临床治疗靶标研究进展缓慢,关键性突破尚未实现,这一困境已成为神经肿瘤领域亟待解决的核心问题。
胶质母细胞瘤特征性的异常血管新生不仅为肿瘤提供营养和氧气支持,更构成了独特的肿瘤微环境【1, 2】。这些结构紊乱的新生血管由血管内皮细胞通过分泌VEGF等促血管生成因子主导形成【3, 4】。值得注意的是,临床研究发现CXCL10高表达的血管内皮细胞与CAR-T细胞治疗的良好预后相关,揭示了胶质母细胞瘤微环境中内皮细胞功能表型的高度异质性【5】。另一方面,胶质母细胞瘤干细胞(Glioblastoma stem cells,GSCs)作为具有自我更新和多向分化潜能的肿瘤起始细胞亚群,不仅是肿瘤发生发展的驱动力,更是治疗抵抗和复发的重要根源。GSCs倾向于定位于血管周围微环境,通过与内皮细胞的复杂双向互作维持其干性特征【6】。然而,研究发现缺氧微环境中的异常血管形成以及抗血管药物贝伐单抗的治疗可能反而增强GSCs的干性和肿瘤侵袭性,这一矛盾现象凸显了内皮细胞对GSCs调控机制的复杂性【7】。因此,深入探究内皮细胞与GSCs间通讯的关键分子及其调控网络【8】,可能为胶质母细胞瘤的药物新靶标发现提供重要的理论依据。
近日,南京医科大学研究团队在Cell Death & Differentiation杂志发表题为Endothelial cells-derived SEMA3G suppresses glioblastoma stem cells by inducing c-Myc degradation的研究论文,阐明了内皮细胞来源的SEMA3G通过诱导干细胞关键标志物c-Myc的降解破坏GSCs干性维持的内在驱动力,从而抑制胶质母细胞瘤的恶性进展。这一研究揭示了靶向SEMA3G-c-Myc轴可能为胶质母细胞瘤患者提供新的治疗策略。

研究团队从血管内皮细胞功能调控角度,通过分析胶质母细胞瘤患者肿瘤组织及癌旁组织的单细胞RNA测序数据,发现肿瘤细胞和血管内皮细胞存在大量差异基因表达。其中,内皮细胞SEMA3G基因的下调最为显著。临床样本分析进一步证实,胶质母细胞瘤患者的肿瘤组织、脑脊液中SEMA3G水平均显著低于非肿瘤患者。这些证据提示,内皮细胞特异性表达的SEMA3G可能参与了胶质母细胞瘤进展,其表达水平变化可能具有潜在临床诊断价值。
随后,研究团队着眼于胶质母细胞瘤的细胞间通讯异常机制的解析,通过CellChat以及免疫组化等实验分析发现,肿瘤细胞是血管源性SEMA3G信号分子的主要作用靶细胞。动物实验结果表明,内皮细胞特异性Sema3G缺失促进原位胶质瘤的生长并缩短荷瘤小鼠的生存期。反之,SEMA3G过表达则明显抑制肿瘤生长并延长生存时间。体外功能实验结果提示,内皮细胞来源的SEMA3G蛋白抑制了GSCs的自我更新和神经球形成能力。
进一步的机制研究与靶标确证研究,发现SEMA3G通过作用于GSCs的NRP2/PLXNA1受体复合物特异性抑制Cdc42-GTP活性(而非RhoA/Rac1),而Cdc42活性状态则动态调控与E3泛素连接酶WWP2的结合偏好:活性Cdc42优先结合WWP2并保护c-Myc免于降解,而SEMA3G通过抑制Cdc42活性促使WWP2转位至c-Myc,介导c-Myc泛素化降解,从而破坏GSCs干性,抑制胶质母细胞瘤的生长。
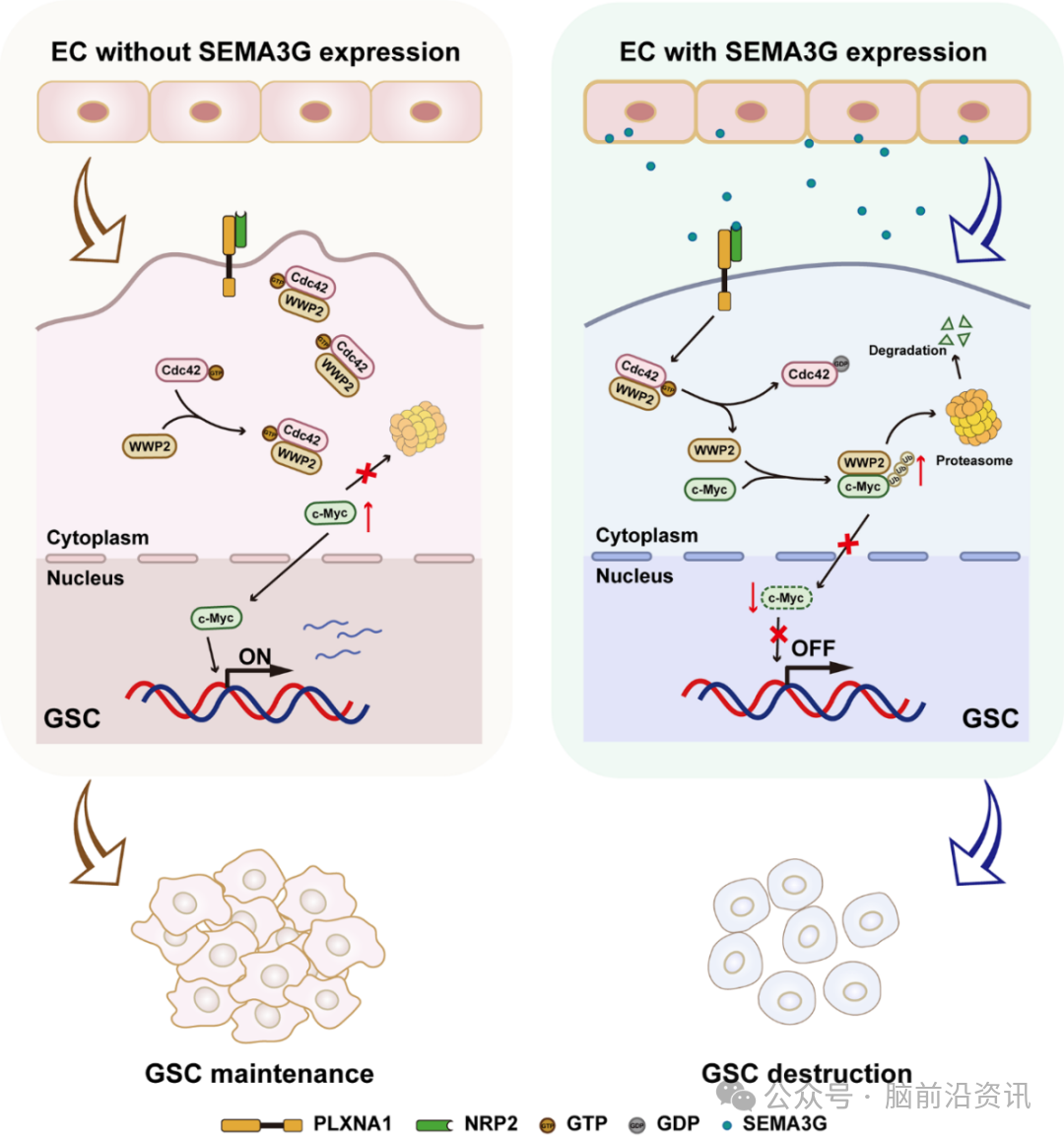
综上,本研究在国际上系统性阐明脑血管内皮源性SEMA3G通过NRP2/PLXNA1-Cdc42-WWP2-c-Myc级联信号轴调控GSCs干性的分子机制,具有以下重要科学价值:1)创新性提出“血管源性信号分子-肿瘤干细胞对话”调控新模式,突破传统肿瘤细胞自主性研究范式,为探究肿瘤微环境对干细胞特的调控机制提供了全新思路;2)首次揭示Cdc42活性状态动态调控WWP2-c-Myc结合取向的精确分子开关,填补了细胞外信号分子与胞内信号转导调控之间的关键知识空白;3)发现SEMA3G-NRP2/PLXNA1这一可靶向干预的分子通路,为开发针对胶质母细胞瘤微环境的精准治疗策略提供了候选新靶点。
原文链接:https://www.nature.com/articles/s41418-025-01534-3
参考文献
[1] Zhao Z, Zhang KN, Wang Q, Li G, Zeng F, Zhang Y, et al. Chinese Glioma Genome Atlas (CGGA): A Comprehensive Resource with Functional Genomic Data from Chinese Glioma Patients. GenomProteomBioinf. 2021 Feb;19(1):1-12.
[2] Carlson JC, Cantu Gutierrez M, Lozzi B, Huang-Hobbs E, Turner WD, Tepe B, et al. Identification of diverse tumor endothelial cell populations in malignant glioma. Neuro Oncol. 2021 Jun 1;23(6):932-944.
[3] Charles N, Ozawa T, Squatrito M, Bleau AM, Brennan CW, Hambardzumyan D, et al. Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells. Cell Stem Cell. 2010 Feb 5;6(2):141-52.
[4] Chen DY, Sun NH, Chen X, Gong JJ, Yuan ST, Hu ZZ, Lu NHN, Jakob K, Fukunaga K, Liu Q, LuYM, HanF. Endothelium-derived semaphorin 3G attenuates ischemic retinopathy by coordinating β-catenin-dependent vascular remodeling. J Clin Invest. 2021 Feb 15;131(4):e135296.
[5] Brown CE, Hibbard JC, Alizadeh D, Blanchard MS, Natri HM, Wang D, et al. Locoregional delivery of IL-13Rα2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nature medicine 2024, 30(4): 1001-1012.
[6] Kang QM, Wang J, Chen SM, Song SR, Yu SC. Glioma-associated mesenchymal stem cells. Brain. 2024 Mar 1;147(3):755-765.
[7] Gilbert MR, Dignam JJ, Armstrong TS, Wefel JS, Blumenthal DT, Vogelbaum MA, et al. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014 Feb 20;370(8):699-708.
[8] Tan C, Lu NN, Wang CK, Chen DY, Sun NH, LyuH, Jakob K, Shi WX, Fukunaga K, Lu YM, Han F.Endothelium-Derived Semaphorin 3G Regulates Hippocampal Synaptic Structure and Plasticity via Neuropilin-2/PlexinA4. Neuron. 2019 Mar 6;101(5):920-937.
来源于【BioArt 脑前沿资讯】
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!


