Oral SMEDDS promotes lymphatic transport and mesenteric lymph nodes target of chlorogenic acid for effective T-cell antitumor immunity
这篇论文研究了口服自微乳化药物递送系统(SMEDDS)对绿原酸(CHA)的淋巴运输和肠系膜淋巴结(MLNs)靶向输送,以提高有效的T细胞抗肿瘤免疫。
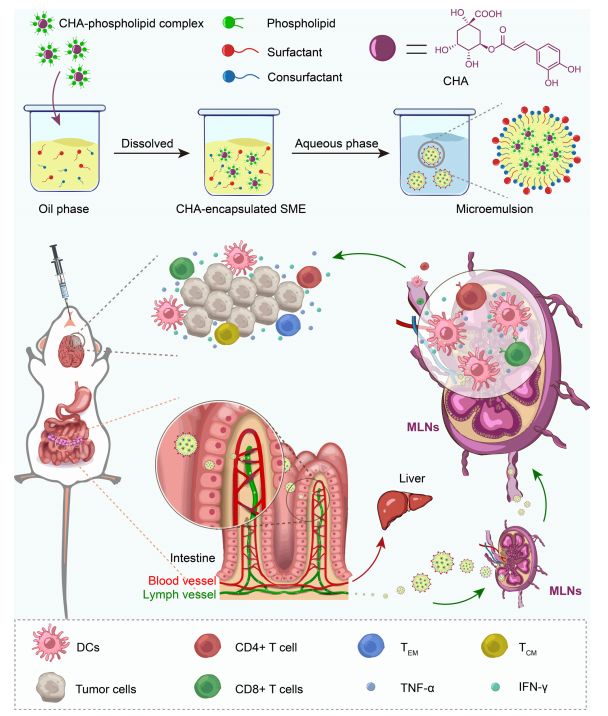
CHA-SME对免疫细胞的制备、肠道淋巴转运和免疫调节作用的示意图
研究背景
1、肠系膜淋巴结(MLNs)是免疫系统的重要淋巴节点,容纳了体内超过一半的淋巴细胞,具有作为癌症免疫治疗靶点的潜力。
2、由于淋巴结的结构和解剖特点,传统药物递送途径难以有效到达淋巴结,且免疫调节剂的口服生物利用度低,淋巴积累有限。
3、自微乳化药物递送系统(SMEDDS)已被证明可以通过肠道淋巴运输途径提高药物的口服生物利用度,但其在免疫调节剂向MLNs的高效递送方面的研究较少。
研究方法
1、开发了CHA-封装的SMEDDS(CHA-SME),通过溶剂蒸发法制备CHA-磷脂复合物,并将其与油相、表面活性剂和助表面活性剂混合,形成透明的微乳液。
2、使用Caco-2细胞和SD大鼠进行体外和体内实验,评估CHA-SME的肠上皮细胞透过性、淋巴运输能力和免疫调节效果。
3、通过动态光散射(DLS)、透射电子显微镜(TEM)和原子力显微镜(AFM)等方法对CHA-SME的粒径、分布和zeta电位进行表征。
实验设计
1、体外实验:评估CHA-SME对Caco-2细胞和C6细胞的细胞毒性,使用CCK-8试剂盒测定细胞活力,并通过LDH释放实验评估细胞膜完整性。
2、细胞摄取实验:使用共聚焦激光扫描显微镜(CLSM)和流式细胞术定量分析Cou-6标记的CHA-SME在Caco-2细胞中的摄取情况。
4、体内实验:建立皮下和原位胶质瘤模型,评估CHA-SME的抗肿瘤效果和免疫调节作用。通过荧光成像和流式细胞术分析CHA-SME在肠道和MLNs中的分布情况。
结果与分析
1、CHA-SME显著提高了CHA在肠道上皮细胞中的渗透性,并通过淋巴运输途径促进了药物在MLNs中的积累。
2、在体外实验中,CHA-SME对Caco-2细胞和C6细胞的细胞毒性较低,细胞活力在CHA浓度为0.01-100 µM时接近100%。
3、在体内实验中,CHA-SME显著抑制了皮下和原位胶质瘤的生长,肿瘤生长抑制率(TGI%)显著高于游离CHA组。
4、CHA-SME显著促进了树突状细胞(DCs)的成熟和T细胞的活化,增加了肿瘤组织中浸润的CD3+、CD4+和CD8+ T细胞的比例。
总体结论
1、CHA-SME通过淋巴运输途径高效地将CHA递送到MLNs,促进了免疫细胞的活化和抗肿瘤免疫反应。
2、口服CHA-SME为胶质瘤的MLNs靶向癌症免疫治疗提供了一种潜在策略,能够绕过免疫检查点阻断疗法中的穿透性差和耐药性问题。
3、该研究强调了通过促进药物在MLNs中的积累来增强淋巴细胞接触和抗肿瘤免疫活性的高效性。
这篇论文展示了CHA-SME在提高CHA的免疫治疗效果方面的潜力,为癌症免疫治疗提供了新的思路。


