Target fishing and mechanistic insights of the natural anticancer drug candidate chlorogenic acid
这篇文章研究了天然抗癌药物候选物绿原酸的直接蛋白质靶点和抗癌分子机制。
研究背景
1、绿原酸是一种天然产物,已被证明在许多临床前模型中有效抑制肿瘤生长,并在中国进行了胶质瘤患者的II期临床试验。然而,CGA的直接蛋白质靶点和抗癌分子机制仍然未知。
2、确定绿原酸的直接蛋白质靶点具有挑战性,因为许多天然产物通过非共价结合与其靶点相互作用,传统的化学蛋白质组学方法难以捕捉这些相互作用。
3、活动性基于探针的蛋白质组学(ABPP)是一种结合了活动性探针(ABP)和蛋白质组学技术的方法,用于识别生物活性天然产物的蛋白质靶点,以帮助阐明其作用模式和副作用。
研究方法
1、设计并合成了一种新型的双功能光亲和探针PAL-绿原酸,基于绿原酸的结构-活性关系(SAR),包含了光亲和性和富集手柄。
2、使用亲和性蛋白质组学(AfBPP)化学蛋白质组学方法,通过多种检测手段(如表面等离子共振(SPR)、等温滴定量热法(ITC)和冷冻电子显微镜(cryo-EM))对ACAT1/绿原酸相互作用进行了深入研究。
3、具体步骤包括:使用Sephadex G-200尺寸排阻柱和HiTrap™ Q HP阴离子交换柱对蛋白质进行纯化和脱盐,使用Thermo Fisher Titan Krios G3i电子显微镜进行cryo-EM单颗粒分析,使用Biacore T200系统进行SPR分析,以及使用EAQ-ITC仪器进行ITC分析。
实验设计
1、通过MTT法评估绿原酸对A375细胞的细胞毒性,细胞在96孔板中以1×10^4细胞/mL的密度接种,在5% CO2条件下孵育12小时,然后在缺氧条件下以1.25-10 mmol/L的绿原酸浓度处理72小时。
2、使用HisTrap HP柱进行亲和色谱纯化ACAT1蛋白,并通过SDS-PAGE确认其纯度。
3、通过热位移试验(TSA)和药物亲和响应靶稳定性(DARTS)试验评估绿原酸与ACAT1的结合稳定性和亲和力。
4、使用cryo-EM单颗粒分析研究ACAT1/绿原酸复合物的结构,数据在Thermo Fisher Titan Krios G3i电子显微镜上收集,使用MotionCor2进行图像对齐和求和,使用CTFFIND4.1进行CTF估计,使用RELION3.1进行粒子挑选和分类。
结果与分析
1、绿原酸通过抑制ACAT1四聚体在Y407残基上的磷酸化,从而抑制癌细胞增殖。
2、SPR分析显示绿原酸与ACAT1的平衡解离常数(KD)约为2.58 mmol/L。
3、ITC数据显示绿原酸与ACAT1的结合具有两个位点,第一个位点的KD为9.68 mmol/L,第二个位点的KD为39.7 mmol/L。
4、cryo-EM结构显示绿原酸通过氢键网络稳定地结合在ACAT1的四聚体上,绿原酸的咖啡酸部分暴露在ACAT1结构的外部,而奎宁酸部分位于变构位点。
5、在体外和体内实验中,绿原酸显著抑制了ACAT1的活性,减少了Y407的磷酸化,增加了丙酮酸脱氢酶(PDH)的活性,从而抑制了肿瘤生长。
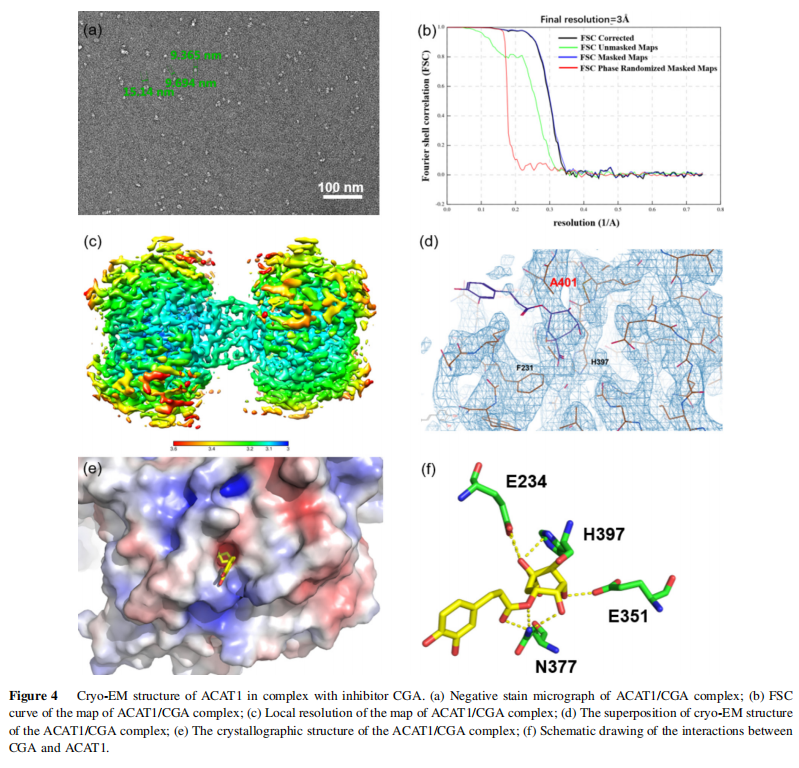
总体结论
1、使用新型双功能光亲和探针PAL/绿原酸和AfBPP化学蛋白质组学方法,首次发现线粒体ACAT1是绿原酸的主要靶蛋白。
2、绿原酸通过非共价结合ACAT1四聚体,诱导广泛的构象变化,导致Y407磷酸化的消除,从而降低ACAT1活性。
3、这种新的作用模式解释了绿原酸的临床益处,并为未来的临床应用提供了新的见解。
这篇文章通过详细的实验设计和多种生物化学技术,揭示了绿原酸作为ACAT1抑制剂的分子机制,为绿原酸在癌症治疗中的应用提供了新的理论基础。


